
Emai:marketing@gdrzzg.com
业务咨询专线:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦东新区川大路585号
邮编:201299
电话:+86 (21) 5859-1500(总机)
传真:+86 (21) 5859-6369






© 2023 上海合乐HL8生物医药股份有限公司 保留所有权利 沪ICP备10216606号-3
沪公网安备 31011502018888号 | 网站地图


业务咨询
中国:
Email: marketing@gdrzzg.com
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




11月29日,合乐HL8临床前毒理研究部副总裁曾宪成博士在基因治疗系列公开课【第4期】中做了主题为《对基因治疗产品非临床研究策略的思考》的报告,本文根据专家报告内容整理,并经专家审核确认。
曾宪成博士,合乐HL8临床前毒理研究部副总裁
高级工程师,2010年在上海医药工业研究院获得医学博士学位,2010-2013年在国家上海新药安全评价研究中心工作,在此期间被派往国家食品药品监督管理总局药品审评中心进行新药审评理论和技术培训和实践;2013年加入合乐HL8普亚医药科技(上海)有限公司,现任毒理研究部副总裁,从事生物技术药物、疫苗及化学药品一般毒性试验研究并承担毒理研究部团队管理工作。作为项目负责人完成了20个1类化药、8个抗体偶联药物、10个单克隆抗体、2个激素药物、2个预防用疫苗及1个复方药物申报中国和/或美国整套的一般毒性和药代动力学研究。作为课题负责人承担了上海市科委资助的实验动物专项研究2项,作为子课题负责人参与了“十一五”国家新药创制重大专项研究。
若按照药物结构分类,部分GT产品其实也属于核酸药物,比如使用非病毒载体递送的GT产品。核酸药物由于它本身独特的物理化学和药理学特点,属于新的临床治疗药物种类,为人类提供了药物研究的新领域。
小分子药物,蛋白药物或抗体药物是当前主要的临床治疗药物类型,靶点主要是蛋白质,比如酶类,受体,离子通道,转运体和激酶等。但寻找一个新的靶点,并开发成药物仍然是困难重重。
在罕见病领域,常规药物难以发挥作用,但或许可以依赖GT产品解决。核酸药物目前主要的应用领域是在单基因干扰,而且比较多的罕见病属于单基因异常,NIH报告目前有7000种罕见病,其中约80%是单基因异常,半数病例为儿童,而95%尚无治疗手段;对于多基因异常的疾病,核酸药物是不是能发挥一定的作用尚待研究。
当前核酸药物治疗分为三个主要方向:补充基因突变失去的功能(如导入正常基因的疗法);抑制或沉默异常基因(如RNA干扰疗法);直接纠正异常基因结构(如基因编辑疗法)。
基因治疗产品一般通过将外源基因(或基因编辑工具)导入靶细胞或组织,替代、补偿、阻断、修正、增加或敲除特定基因以发挥治疗作用。按照基因导入人体的方式不同,基因治疗可分为体内(in vivo)基因导入和体外(ex vivo)基因导入两种方式。
体内基因治疗产品将外源基因(或基因编辑工具)通过适当的载体直接导入人体发挥治疗作用,而体外基因治疗产品一般在体外将外源基因(或基因编辑工具)导入细胞,制备成为经基因修饰的细胞或细胞衍生产品,最终经回输以发挥治疗作用。(NMPA,《体内基因治疗产品药学研究与评价技术指导原则》(试行),2022.05)
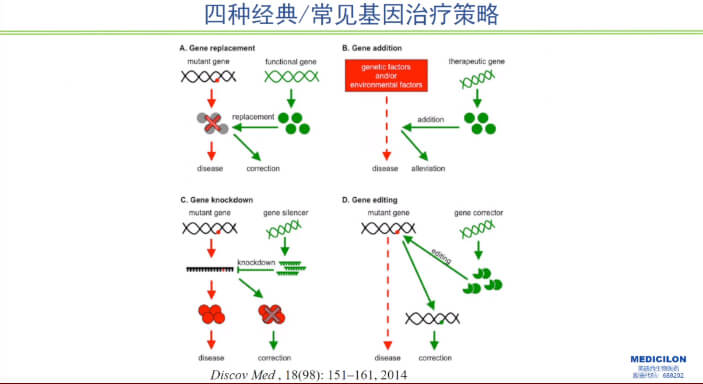
图1 四种经典/常见基因治疗策略
对GT产品来讲,递送系统是它研究的一个重要方面,到目前为止还没有一个非常理想的递送系统。目前GT产品常用的递送系统可以分为病毒和非病毒载体系统。病毒载体系统目前用的比较多的有逆转录病毒,慢病毒,腺病毒(免疫原性较强)和腺相关病毒等。非病毒载体主要有脂质纳米粒等。
病毒和非病毒载体进入细胞方式、特点及其后续命运决定了组织分布必会成为这类药物研究的重点。另外一方面,应该选择什么动物种属?两种载体进入细胞的方式,转基因从内吞小体的释放,入细胞核方式,后续的转录及翻译过程等都是试验动物种属相关性考虑的重点。另外还要考虑相关种属解剖结构(比如大脑和脊髓解剖结构、组织尺寸大小及功能方面;大动物,如猴和猪,比大鼠更接近人,尤其是病毒载体,因为病毒传播一个重要途径是通过神经。)
相关动物种属的选择还应该考虑以下方面:药效靶器官被有效转导;载体安全性已知;转基因表达水平与人体可比性;该种属动物可以呈现该疾病状态;动物对基因修饰细胞及转基因表达产物的生物学反应与预期的人体反应的相似性;动物对异种来源的基因修饰细胞的免疫耐受性;动物病理生理学特征与拟用患者人群的相似性;临床拟用递送/给药方式的可行性。
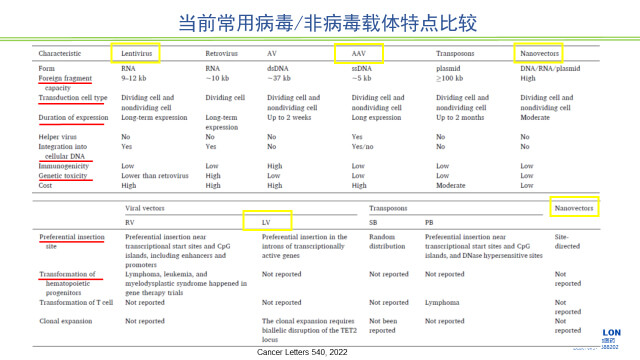
图2 当前常用病毒/非病毒载体特点比较
正因为病毒载体,尤其是逆转录,有整合到基因组的风险,所以使用病毒载体,尤其是逆转录病毒载体的GT产品通常要评估致癌性。所以对于基因修饰细胞产品来说,致癌性的评估在指导原则中又被放到非常醒目的位置。
2021年《基因治疗产品非临床研究与评价技术指导原则(试行)》中对致癌性的评估要求有以下几点:标准的啮齿类动物致癌性试验一般不适于评价基因治疗产品。可采用证据权重(Weight of Evident, WoE)方法来评估致癌风险,必要时进行致癌性研究。WoE关注因素一般包括但不限于:药物靶点和药理作用通路与致癌性相关(例如导入基因产物是生长因子);靶点和信号通路的药理作用特征预测与肿瘤发生发展有一定相关性。插入突变研究的相关结果提示有致癌风险。载体设计中有潜在致癌风险;生产体系中存在引入致癌成分。一般毒理学试验组织病理学发现,包括弥漫性和/或局灶性细胞增生、持续的组织损伤和/或慢性炎症,癌前病变和肿瘤发生;激素紊乱。免疫抑制等。目前对基因修饰的细胞产品,除要进行上述致癌性评估外,还需要进行成瘤性评价。
以病毒为载体的基因治疗产品在体内的发生过程如图3。AAV的细胞表面黏附由初级糖链受体介导,并由蛋白质类次级受体稳定。然后以AAV为基础的载体在通往细胞核的过程中利用多种内吞途径。随后RAAV衣壳在分选室(内小体和高尔基体)中经历了实质性的构象变化。在逃离分选室后,载体粒子聚集在核周空间,并通过核孔复合体进入细胞核。在细胞核内,载体基因组被释放和转录,实现转基因的表达。
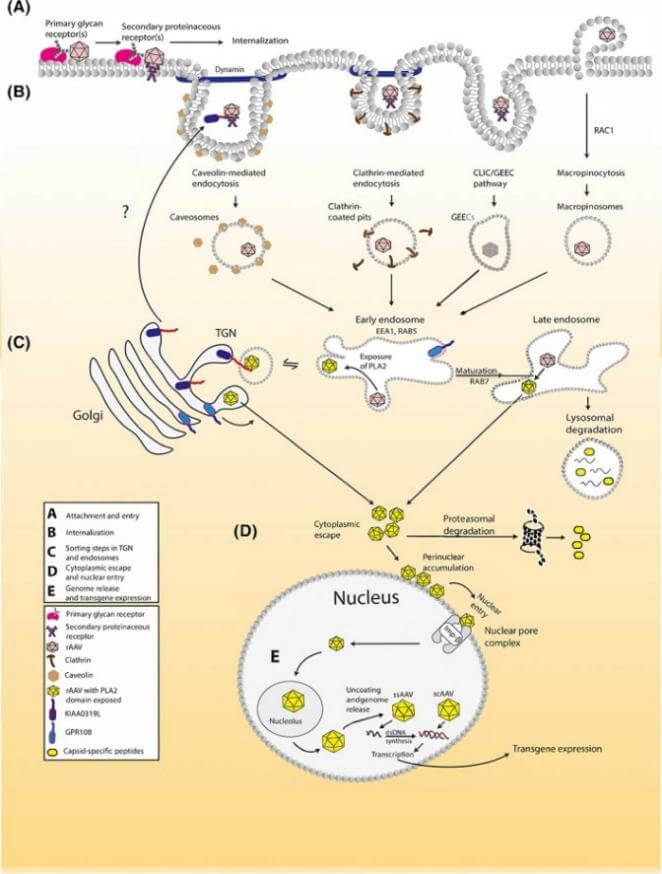
图3 以AAV病毒载体为例
经典的基因治疗产品体内过程
如图4显示的是GT产品进行非临床评价项目一般策略。药理学研究方面需要做动物模型有效性研究,概念验证及安全药理;药代动力学的研究则要重点研究暴露量,生物分布及脱落研究;毒理学方面要做一般毒理学,免疫原性,免疫毒性,遗传生殖毒性,致癌性,局部耐受性和病毒脱落风险(尤其是复制型病毒)研究。
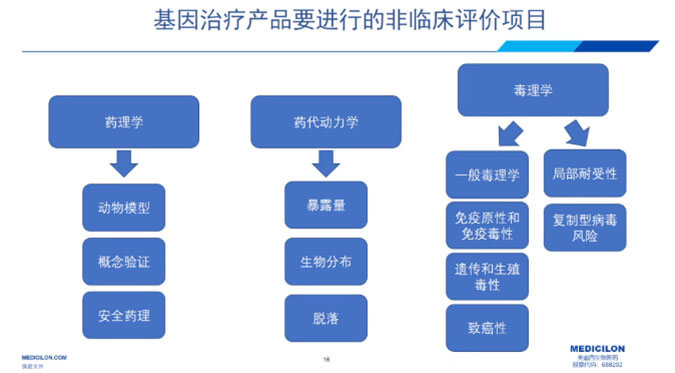
图4 基因治疗产品要进行的非临床评价项目
除此之外,2017年欧盟、美国、日本等三个政府或经济联合体在Yale Journal of Biology and Medicine上发表文章推荐基因治疗产品非临床安全研究要关注以下问题:制剂组分引起的毒性(比如脂质体不同组分及其它污染物,轻则产生免疫原性重则会致癌),给药途径引起的毒性(局部用药还是系统用药),非靶细胞/组织异常分布(脱靶问题),载体及转基因持续表达及其表达水平(直接决定了实验动物数据的价值),非靶细胞/组织病毒复制水平,免疫激活和抑制,针对载体的免疫反应,靶细胞活化状态/表型,潜在的插入突变/致癌,潜在的生殖器官传播,潜在的由患者向家庭成员及照料者的水平传播(如脱落)等。
GT产品的病毒/非病毒载体递送的是核酸。在机体漫长的进化过程中衍生了一系列识别外来物质的系统或通路,如模式识别受体。当核酸被模式识别受体识别后先会引起先天性免疫反应,这也正是我们要关注的基因治疗产品给药之后引起的早期/急性毒性反应。无论病毒还是非病毒载体,由于递送内容化学结构非常相似,会共用相同识别系统,最后产生相似的生物学效应,如产生I型干扰素,II型干扰素,细胞因子等。同时为后期激活适应性免疫做铺垫。后期产生的适应性免疫主要分为细胞免疫和体液免疫,体液免疫是针对病毒的衣壳,或病毒衣壳被降解之后的产物,或转基因表达产物等外来物质产生相应的抗体。如果是细胞治疗产品,本身就会引起细胞免疫反应。病毒载体免疫原性来源分析如图5。

图5 病毒载体免疫原性来源分析
在做非临床毒性研究时要重点关注先天性免疫和适应性免疫反应,常用ELISA,qPCR,ELISpot等方法监测,有时候需要对产生的抗体进行中和抗体属性鉴定时候会采用一些干扰活性潜能研究的方法。
当我们获悉了免疫原性来源之后将会增加对指导原则相应条款及要求的理解。指导原则中提到:基因治疗产品可能导致的免疫反应包括先天性免疫和适应性免疫反应。多种因素可显著影响基因治疗产品的先天性和适应性免疫反应,如宿主因素(前期接触过相关病毒血清型和/或导入基因产物,免疫系统状态)、基因递送方式(递送系统种类、给药途径和靶组织)、载体(载体种类、血清型、剂量和导入基因的调控原件类型等)、导入基因的产物、异位表达基因产物(特别是针对免疫豁免器官和/或部位特异性表达的基因产物)。基因治疗产品的免疫原性可能来源于产品中的非人源化组分、导入基因的表达产物、载体、基因编辑产生的非预期的肽/蛋白质等。病毒载体类基因治疗产品相对更容易产生免疫原性。此外,还应考虑实验动物预存免疫对试验的影响。
既然免疫原性不可避免,可以做一些消除免疫原性影响的工作。常见策略是使用药物干预而实现免疫抑制。目前研究文献中也有提到其他方式,如通过控制剂量并利用肝脏独特的不活跃的免疫环境,或利用AAV-CAR Tregs来控制病毒载体的免疫原性。(Frontiers Immunology,2020:11;Molecular Therapy: Methods & Clinical Development,2021:23)。除上述提到的控制免疫原性的策略之外,还有诸多其他不同的方式。这主要是提醒我们,要关注到预存抗体对实验结果的影响,如果研究这类产品,没有做预存抗体筛选,注定实验结果多数情况下会失败或无申报价值。
病毒载体组织分布及排出/脱落(shedding)研究重点要关注大脑,两大传播途径,即血液和神经等;除此之外还要关注在生殖系统有没有分布。了解上述内容之后,关于指导原则对生物分布(含排出/脱落)研究的规定就更容易理解了。在生殖毒性研究方面,基因治疗产品应根据受试者的产品类型、作用机制、一般毒理发现、生物分布特征以及患者人群来评估潜在的生殖/发育毒性风险。如果基因治疗产品拟用于有生育可能或妊娠人群,应研究产品对胎儿的影响(例如细胞因子局部生成后通过胎盘转运),开展胚胎-胎仔发育和围产期毒性试验。如果在一般毒理学试验中发现有潜在的生殖器官毒性反应,应开展生育力和早期胚胎发育毒性试验。当基因治疗产品在生殖器官持续存在时,需要进一步确定其在生殖细胞(例如卵母细胞、精子)的暴露水平。
当前GT治疗产品在以下几个方面存在挑战:
1. 在实验研究设计/安排方面,长周期的毒性研究(如6个月毒性试验)是否总是需要;选择毒性试验剂量的最好方法;若有免疫原性,进行毒性研究的最好方式;生物分布研究需要采集多少组织;如果采用相同的病毒衣壳及增强子或相同的脂质纳米粒递送系统,但转基因不同,是否仍需要进行生物分布研究;如果已有文献数据证明低风险,对于低/不整合的载体是否仍有必要进行整合性研究;
2. 研究数据分析方面,动物体生物分布/表达/不良反应如何外推至人;历史数据缺乏;
3. 不同方法间、同一家公司不同场所间、公司和外包生产商间、外包生产商批次间等产品间质量一致性方面,什么样的体外比对研究已经可以充分说明可比性;多大的产品不同会导致额外毒性研究;何时及需要哪些研究以研究清楚差异的影响;
4. 后期开发方面,需要哪些研究以支持有妊娠需求妇女用药;
5. 监管方面,某些方面在不同监管机构间尚未达成一致;晚期开发如何进行缺乏清晰的指导原则(如生殖发育毒性试验及致癌性试验策略)(Molecular Therapy: Methods & Clinical Development,2020 )。
12月20日20:00-21:30
基因治疗公开课(第5期)将开始直播
欢迎观看
